|
Kapitel 4. |
|
I to tusind år, lige siden Aristoteles tid, betragtede naturforskerne det som givet, at alt i verden bestod af de fire grundlæggende elementer: luft, jord, vand og ild. Men da det syttende og attende århundredes eksperimentelt indstillede naturvidenskabsmænd begyndte at opgive lænestols-spekulationerne til fordel for håndgribelige videnskabelige beviser, blev det åbenbart, at luft, jord, vand eller ild hverken var grundliggende eller grundstoffer.
Tabet af denne rodfæstede tro var i sig selv et hårdt slag, men endnu værre var det, at der ikke var noget til at erstatte den. I stedet for kun at have fire universelle byggesten, var der nu otte, ti, tolv, tyve eller halvtreds. Omkring 1860 havde det samlede antal af kendte grundstoffer oversteget de tres, og man kunne endda ikke se en ende på dem. I dag (1969) er der 103. Hvordan skille kemikerne kunne få nogen samling på denne stadig voksende samling af reaktioner og forbindelser, hvis hvert stof var forskellig fra ethvert andet, og hvis der hele tiden blev opdaget nye stoffer?
Heldigvis gik det sådan, at netop på det tidspunkt, hvor situationen synes helt kaotisk, viste der sig i horisonten en i hvert fald delvis løsning i form af et forbløffende klassificeringsskema, opstillet af den russiske kemiker Mendelejev i 1869. Han var ikke alene i stand til at vise klare slægtskabsforbindelser mellem grundstoffer, som tilsyneladende havde lidet fælles, han var yderligere i stand til at forudsige eksistensen af visse grundstoffer, længe før de virkelig blev opdaget. På baggrund af det 20. århundredes viden, har vi en anelse om, hvordan Mendelejevs bemærkelsesværdige "periodiske system" er i stand til at give korrekte oplysninger, der er baseret på teori.
Et grundstofs kemiske egenskaber er bestemt af antallet af dets elektroner eller protoner. Denne mængde kaldes grundstoffets atomnummer. Den samlede masse af protoner og neutroner i atomets kærne kaldes dets massenummer. Nogle grundstoffer forekommer i forskellige former, der kaldes isotoper. Alle isotoper af samme grundstof har samme antal protoner (og elektroner), men afviger i deres antal neutroner. Derfor har isotoper af samme grundstof samme atomnummer, men forskellige massenumre. Der er atomnummeret, der giver et grundstof dets særlige identitet. To atomer med forskellige massenumre kan begge være samme grundstof, men to atomer med forskelligt atomnummer - d.v.s. forskelligt antal protoner - kan aldrig være samme grundstof.
Atomvægten er vægten af atomet af et grundstof, som det forekommer i naturen, målt i forhold til vægten af kulstof, som det er besluttet at sætte til 12. Hvis et grundstof har mere end een naturligt forekommende isotop, er dets atomvægt gennemsnitsvægten af disse isotoper under hensyntagen til det indbyrdes forhold, hvori de forekommer. Af denne grund er et grundstofs atomvægt et helt tal og sjældent det samme som massenummeret.
Ifølge Niels Bohrs oprindelige atomteori, der blev opstillet i 1913, bevæget et atoms elektroder sig i cirkulære eller elliptiske baner rundt om kernen på tilsvarende måde, som planeterne bevæger sig omkring solen. Men ifølge den mere "eksklusive" kvanteteori er elektronernes opførsel slat ikke så regelbunden. Selv om de er tilbøjelige til at holde sig i beregnede afstande fra kernen, har de også en tilbøjelighed til at flyve i alle mulige retninger snarere end at følge veldefinerede omløbsbaner. Resultatet er en tredimensionel sky- eller skalvirkning i stedet for cirkler eller ellipser.
Omkring 1869 offentliggjorde den russiske kemiker Mendelejev sit nu berømte periodiske system. Han ordnede grundstofferne i familier, men efterlod tomme pladser i systemet for at grundstoffer med ens egenskaber kunne optræde i samme lodrette kolonne, som han kaldte grupper.
Mendelejev fremsatte nogle bemærkelsesværdige forudsigelser vedrørende de ukendte grundstoffer, der skulle udfylde hullerne i hans system. For eksempel forudsagde han egenskaberne hos et metallisk grundstof, der skulle udfylde hullet mellem aluminium og zink. Da man i 1875 opdagede grundstoffet gallium, viste hans forudsigelser sig at være forbavsende nøjagtige. Det manglende grundstof under silicium i gruppe IV kaldte han for ekssilicium. Han forudsagde, at det ville være et gråhvidt, ikke reaktivt metal med en atomvægt på ca. 73. Dette grundstof blev opdaget 15 år senere af den tyske kemiker Clemens Winckler, det fik navnet germanium, og det viste sig at have en atomvægt på 72,6.
Hvis vi ser på tværs hen over en model af det periodiske system, (fig. 6, 1), ser vi grundstofferne ordnet i rækker, der kaldes perioder, og hvoraf der er syv. Den oprindelige grund til at arrangere grundstofferne på denne måde var at få dem ordnet sådan, at ethvert grundstof havde en højere atomvægt end dets nærmeste nabo til venstre. Dette var vigtigt, da man så kunne antage, at nogle af de atomvægte, som var beregnet på dette tidspunkt, var forkerte. De passede nemlig ikke ind i skemaet, som de skulle. Ofte viste det sig også, at da disse grundstoffers atomvægte blev beregnet rigtigt, passede de fint ind i systemet. I dag bliver grundstofferne ikke ordnet efter stigende atomvægt, da de ikke er helt regelmæssige, men efter stigende atomtal.
Hvert grundstof har et proton mere i kernen end det foregående, og på den måde er atomnumrene een ubrudt række fra 1 til 103. Hvad gør vi ved de akavede overgangsgrundstoffer og de sjældne jordarters metaller, som gør nar af det meget nydelige system. Vi må tilgive dem, de opfører sig nøjagtigt, som naturen forlanger, at de skal. Det er os som griber ind i naturens orden ved at kræve, at alle grundstoffer skal passe ind i et system med syv rækker og et større antal kolonner. Det er et forhold, vi ofte må acceptere, at der er en god orden, men der er også undtagelser.
Fig. 4.1
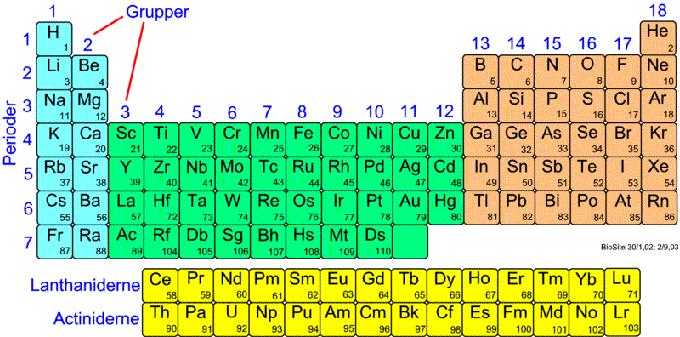
Udviklingen af det periodiske system og hele den teori, der er nødvendig for at forklare det, har bidraget meget til at øge kemikernes forståelse af de reaktioner, der foregår og har givet dem en øget kontrol med de kemiske reaktioner, de iværksætter. Selv om vejen ofte kan synes brydsom, er det hele denne fortolkning af de kemiske reaktioner, der er direkte ansvarlig for de kolossale muligheder for at øge det moderne samfunds levestandard, som den kemiske industri, og deraf afledte industrier har bragt os.
Der er flere årsager til, at jeg har valgt at give en relativ grundig fremstilling af atomerne og det periodiske system.
Først og fremmest fordi der er en slående lighed mellem modellen af det periodiske system og den i viste model af de syv stofplan, ligesom der er 7 stofplan, er der også 7 perioder i det periodiske system.
Dernæst fordi, at metoden Mendelejev brugte, da han udviklede systemet, idet han først fremførte modellen og siden kontrollerede, om den var rigtig, svarer ganske godt til den åndsvidenskabelige metode.
Og sidst fordi eksemplet viser, at selv i en så eksagt videnskab som kemien, må man acceptere undtagelser fra reglerne, og det kan vi selvfølgelig selvfølgelig heller ikke undgå i åndsvidenskaben.